Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10
Mục Lục
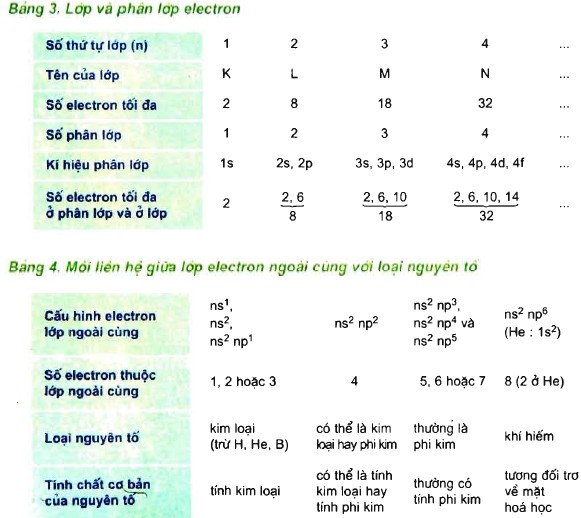
A – KIẾN THỨC CẦN NẮM VỮNG
Bạn đang đọc: Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10
B – BÀI TẬP
Dưới đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10 không thiếu và ngắn gọn nhất. Nội dung cụ thể bài giải những bài tập những bạn xem sau đây :
1. Giải bài 1 trang 30 hóa 10
Thế nào là nguyên tố $ s, p, d, f USD ?
Bài giải:
– Nguyên tố s là những nguyên tố mà nguyên tử có electron ở đầu cuối được điền vào phân lớp s .
– Nguyên tố p là những nguyên tố mà nguyên tử có electron sau cuối được điền vào phân lớp p .
– Nguyên tố d là những nguyên tố mà nguyên tử có electron sau cuối được điền vào phân lớp d .
– Nguyên tố f là những nguyên tố mà nguyên tử có electron ở đầu cuối được điền vào phân lớp f .
2. Giải bài 2 trang 30 hóa 10
Các electron thuộc lớp K hay lớp L link với hạt nhân ngặt nghèo hơn ? Vì sao ?
Bài giải:
Các electron thuộc lớp K link với hạt nhân ngặt nghèo hơn lớp L vì gần hạt nhân hơn và mức nguồn năng lượng thấp hơn .
3. Giải bài 3 trang 30 hóa 10
Trong nguyên tử, những electron của lớp nào quyết định hành động đặc thù hoá học của nguyên tử nguyên tố đó ? Cho thí dụ .
Bài giải:
Trong nguyên tử, những electron ở lớp ngoài cùng quyết định hành động đặc thù hoá học của nguyên tử nguyên tố .
Thí dụ : Liti, natri có 1 e ở lớp ngoài cùng nên bộc lộ đặc thù của sắt kẽm kim loại, oxi và lưu huỳnh đều có 6 e ở lớp ngoài cùng nên bộc lộ đặc thù của phi kim .
4. Giải bài 4 trang 30 hóa 10
Vỏ electron của một nguyên tử có 20 electron. Hỏi :
a ) Nguyên tử đó có bao nhiêu lớp electron ?
b ) Lớp ngoài cùng có bao nhiêu electron ?c ) Nguyên tố đó là nguyên tố sắt kẽm kim loại hay phi kim ?
Bài giải:
Cấu hình electron : 1 s2 2 s2 2 p5 3 s2 3 p6 4 s2 .
a) Nguyên tử có 4 lớp electron.
b) Lớp ngoài cùng có 2 electron.
c) Do nguyên tử nguyên tử có 2e lớp ngoài cùng nên nguyên tố đó là kim loại.
5. Giải bài 5 trang 30 hóa 10
Cho biết số electron tối đa ở những phân lớp sau :
a ) 2 s ; b ) 3 p ; c ) 4 s ; d ) 3 d .
Bài giải:
Số electron tối đa ở những phân lớp s, p, d, f tương ứng là 2, 6, 10, 14. Do đó, ta có :
a) 2s có tối đa 2e: 2s2.
b) 3p có tối đa 6e: 3p6.
c) 4s có tối đa 2e: 4s2.
d) 3d có tối đa 10e: 3d10.
6. Giải bài 6 trang 30 hóa 10
Cấu hình electron của nguyên tử photpho là 1 s22s22p63s23p3. Hỏi :
a ) Nguyên tử photpho có bao nhiêu electron ?
b ) Số hiệu nguyên tử của photpho là bao nhiêu ?
c ) Lớp electron nào có mức năng tượng cao nhất ?
d) Có bao nhiêu lớp electron, mỗi lớp có bao nhiêu electron ?
e ) Photpho là nguyên tố sắt kẽm kim loại hay phi kim ? Vì sao ?
Bài giải:
a) Nguyên tử photpho có 15e.
b) Số hiệu nguyên tử của photpho là 15.
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) Có 3 lớp e. Lớp thứ nhất có 2 e, lớp thứ 2 có 8 e, lớp thứ 3 có 5 e.
e) Photpho là phi kim vì có 5e ở lớp ngoài cùng.
7. Giải bài 7 trang 30 hóa 10
Cấu hình electron của nguyên tử cho ta những thông tin gì ? Cho thí dụ .
Bài giải:
Cấu hình electron của nguyên tử cho ta biết : sự phân bổ electron trên những lớp và phân lớp. Qua thông số kỹ thuật electron ta biết được cấu trúc nguyên tử, vị trí của nguyên tố trong bảng tuần hoàn và đặc thù hóa học đặc trưng của nguyên tố đó .
Thí dụ : Nguyên tố Na có thông số kỹ thuật electron là : 1 s2 2 s2 2 p6 3 s1 .
– Cấu tạo nguyên tử : điện tích hạt nhân là 11 +, nguyên tử có 3 lớp electron và có 1 e ở lớp ngoài cùng .
– Vị trí của nguyên tố trong bảng tuần hoàn : ô số 11, chu kì 3, nhóm IA .
– Tính chất hóa học đặc trưng : do có 1 e lớp ngoài cùng nên Na là một sắt kẽm kim loại mạnh .
8. Giải bài 8 trang 30 hóa 10
Viết thông số kỹ thuật electron khá đầy đủ cho những nguyên tử có lớp electron ngoài cùng là :
a ) 2 s1 ; b ) 2 s2 2 p3 ; c ) 3 s23p6 ;
d ) 3 s2 3 p3 ; e ) 3 s2 3 p5 ; g ) 2 s2 2 p6 .
Bài giải:
Cấu hình electron vừa đủ cho những nguyên tử :
a) 1s2 2s1 ;
b) 1s2 2s2 2p3 ;
c) 1s2 2s2 2p6 ;
d) 1s2 2s2 2p6 3s2 3p3 ;
e) 1s2 2p6 3s2 3p5 ;
g) 1s2 2s2 2p6 3s2 3p6.
9. Giải bài 9 trang 30 hóa 10
Cho biết tên, kí hiệu, số hiệu nguyên tử của :
a ) 2 nguyên tố mà nguyên tử có số electron lớp ngoài cùng là tối đa ;
b ) 2 nguyên tố mà nguyên tử có 1 electron ở lớp ngoài cùng ;
c ) 2 nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng .
Bài giải:
a) \( _{10}^{20}\textrm{Ne}\) và \( _{18}^{40}\textrm{Ar}\);
\ ( _ { 10 } ^ { 20 } \ textrm { Ne } \ ) : 1 s22s22p6 ⇒ có 8 e lớp ngoài cùng .
\ ( _ { 18 } ^ { 40 } \ textrm { Ar } \ ) : 1 s22s22p63s23p6 ⇒ có 8 e lớp ngoài cùng .
b) \( _{11}^{23}\textrm{Na}\) và \( _{19}^{39}\textrm{K}\);
\ ( _ { 11 } ^ { 23 } \ textrm { Na } \ ) : 1 s22s22p63s1 ⇒ có 1 e lớp ngoài cùng .
\ ( _ { 19 } ^ { 39 } \ textrm { K } \ ) : 1 s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
c) \( _{17}^{35}\textrm{F}\) và \( _{17}^{35}\textrm{Cl}\).
\ ( _ { 9 } ^ { 19 } \ textrm { F } \ ) : 1 s22s22p5 ⇒ có 7 e lớp ngoài cùng .
\ ( _ { 17 } ^ { 35 } \ textrm { Cl } \ ) : 1 s22s22p63s23p5 ⇒ có 7 e lớp ngoài cùng .
Bài trước:
Bài tiếp theo:
Xem thêm :
Trên đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10 không thiếu, ngắn gọn và dễ hiểu nhất. Chúc những bạn làm bài môn hóa học 10 tốt nhất !
“ Bài tập nào khó đã có giaibaisgk.com “
Source: https://evbn.org
Category : blog Leading















![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


