Đề thi học sinh giỏi cấp huyện môn Hóa học 8- Phòng GD & ĐT Kinh Môn có đáp án
PHÒNG GD & ĐT HUYỆN KINH MÔN
ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC 8
THỜI GIAN: 120 PHÚT
Câu I (2 điểm)
- Chọn các chất thích hợp ứng với mỗi chữ cái. Viết phương trình hóa học hoàn thành chuỗi phản ứng sau:
A ( xrightarrow { { { t ^ o } } } ) O2 ( xrightarrow { { { H_2 } } } ) C ( xrightarrow { { Na } } ) D
Biết D là hợp chất tan được trong nước tạo dung dịch làm quỳ tím hóa xanh.
2. Nêu hiện tượng kỳ lạ quan sát được, viết phương trình hóa học lý giải. Khi cho một viên kẽm ( Zn ) vào ống nghiệm chứa dung dịch axit : H2SO4 ( loãng ) 3. Hoàn thành những phương trình hóa học theo sơ đồ phản ứng sau. a. Na + H3PO4 → Na3PO4 + ? b. FexOy + CO → Fe3O4 + CO2 c. Fe3O4 + HCl → FeCl2 + FeCl3 + ? d. CxHyOz + O2 → CO2 + H2O
Câu II (2 điểm)
1. Nêu phương pháp hóa học phân biệt những khí trong 4 lọ riêng không liên quan gì đến nhau sau : O2, H2, CO2, N2. 2. Hoà tan 5,72 gam Na2CO3. xH2O trong 44,28 gam nước được dung dịch có nồng độ 4,24 %. Xác định công thức tinh thể ngậm nước.
Câu III (2 điểm)
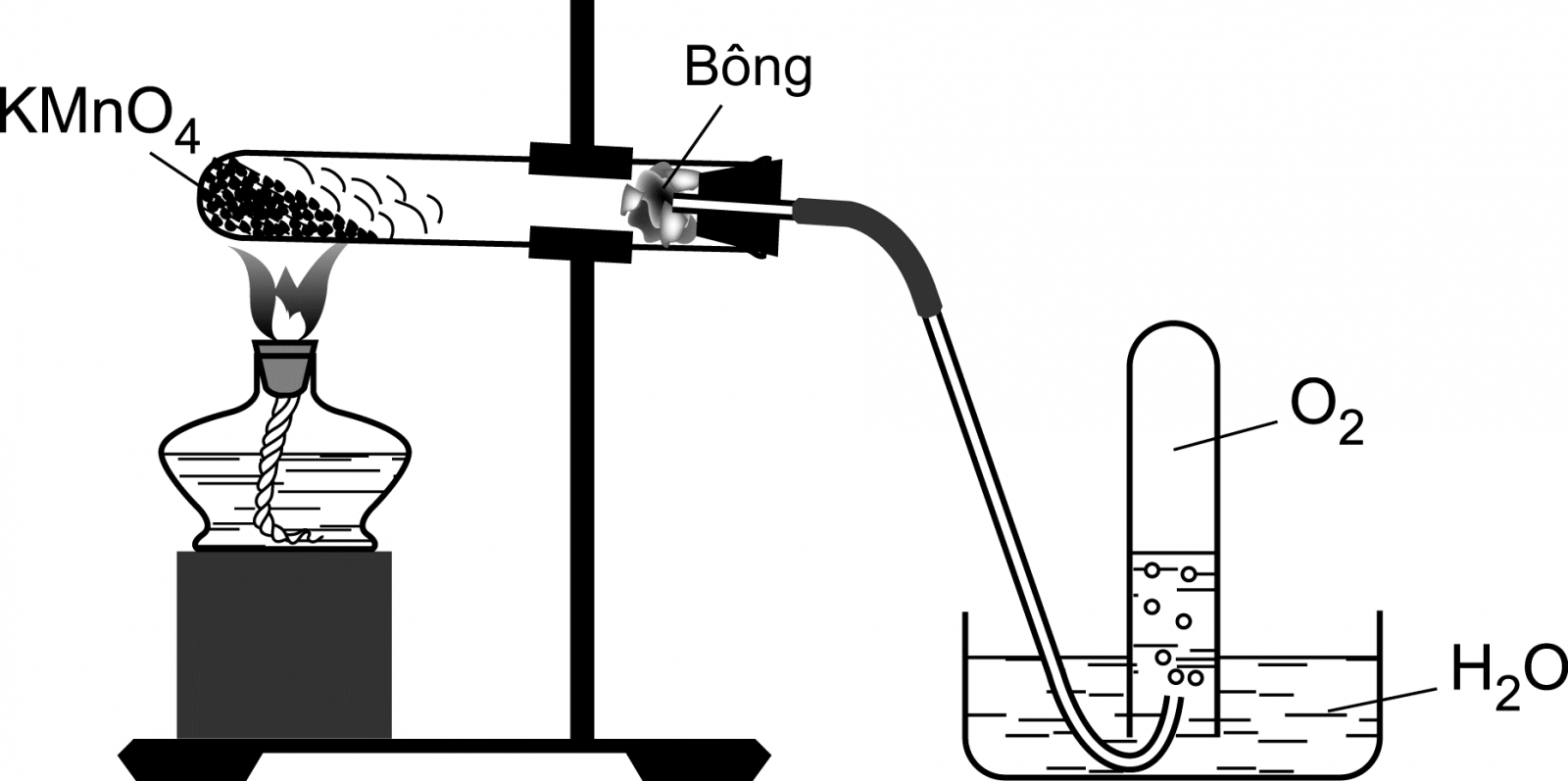
| 1. Hình vẽ bên miêu tả thí nghiệm điều chế O2 trong phòng thí nghiệm bằng cách nhiệt phân KMnO4. Hãy cho biết : Khí O2 được thu bằng chiêu thức nào ? Phương pháp này dựa trên đặc thù nào của O2 ? Viết phương trình hóa học. |
|
2. Cho luồng khí H2 ( dư ) lần lượt đi qua những ống mắc tiếp nối đuôi nhau đựng những oxit nung nóng trong mỗi ống riêng không liên quan gì đến nhau sau : ống 1 chứa 0,01 mol CaO ; ống 2 chứa 0,01 mol Fe3O4 ; ống 3 chứa 0,02 mol Al2O3 ; ống 4 chứa 0,01 mol CuO ; ống 5 chứa 0,06 mol Na2O. Tính khối lượng chất rắn thu được trong mỗi ống sau phản ứng ? ( Biết những phản ứng hóa học xảy ra trọn vẹn )
Câu IV (2 điểm)
1. Cho luồng khí hiđro đi qua ống thuỷ tinh chứa 20 g bột đồng ( II ) oxit ở nhiệt độ cao. Sau phản ứng thu được 16,8 g chất rắn. Tính thể tích khí hiđro ( đktc ) tham gia phản ứng trên. 2. Hòa tan 8,7 gam hỗn hợp gồm sắt kẽm kim loại Kali ( K ) và một sắt kẽm kim loại R ( hóa trị II ) trong dung dịch axit HCl lấy dư thấy có 5,6 lít H2 ( đktc ) thoát ra. Mặt khác nếu hòa tan riêng 9 gam sắt kẽm kim loại R trong HCl dư thì thể tích khí H2 sinh ra chưa đến 11 lít ( đktc ). Hãy xác lập sắt kẽm kim loại R.
Câu V (2 điểm)
1. Đốt cháy trọn vẹn 3,36 lít hỗn hợp X ( đktc ) gồm CH4, C2H2, C2H4, C3H6, C4H10 thì thu được 12,32 lít CO2 ( đktc ), và 10,8 gam H2O. a. Tính khối lượng hỗn hợp X. b. Xác định tỉ khối của X so với H2. 2. Đặt 2 chiếc cốc thủy tinh lên 2 đĩa cân và kiểm soát và điều chỉnh cân cân đối, lấy a gam mỗi sắt kẽm kim loại Al và Fe cho vào hai cốc đó, rồi rót từ từ vào hai cốc cùng một lượng dung dịch chứa b mol HCl. Tìm điều kiện kèm theo giữa a và b để cân cân đối. ĐÁP ÁN
|
Câu |
Ý |
Hướng dẫn chấm |
Điểm |
|
I |
1 2 |
– Các vần âm tương ứng với mỗi chất là : A : KClO3 ; B : O2 ; C : H2O ; D : NaOH. – PTHH : 2KC lO3 to → 2KC l + 3O2 O2 + 2H2 to → 2H2 O 2 H2O + 2N a → 2N aOH + H2 – Xung quanh viên kẽm có bọt khí không màu bay lên, viên kẽm tan dần. Zn + H2SO4 → ZnSO4 + H2 |
0,25 0,25 0,25 0,25 |
|
3 |
a. 6N a + 2H3 PO4 → 2N a3PO4 + 3H2 b. 3F exOy + ( 3 y – 4 x ) CO to → xFe3O4 + ( 3 y – 4 x ) CO2 c. Fe3O4 + 8HC l → FeCl2 + 2F eCl3 + 4H2 O d. CxHyOz + ( x + y / 4 – z / 2 ) O2 to → xCO2 + y / 2 H2O |
0,25 0,25 0,25 0,25 |
|
|
II |
1 |
– Đánh STT từng lọ khí cần phân biệt. Dẫn một lượng mỗi khí qua que đóm còn than hồng. Nếu thấy 1 khí nào làm que đóm phát cháy đó là khí O2. Các khí còn lại không làm que đóm phát cháy. – Dẫn những khí còn lai đi qua dung dịch nước vôi trong lấy dư. Nếu thấy một chất khí nào phản ứng làm nước vôi trong vẩn đục trắng đó là khí CO2. Các khí còn lại không làm vẩn đục nước vôi. CO2 + Ca ( OH ) 2 → CaCO3 + H2O – Đốt những khí còn lại, khí nào cháy với ngọn lửa màu xanh nhạt là khí H2
H2 + O2 to → H2O – Khí không cháy là N2 |
0,25 0,25 0,25 0,25 |
|
2 |
Khối lượng Na2CO3 có trong 5,72 g là: Khối lượng dung dịch thu được : mdd = 5,72 + 44,28 = 50 g Ta có : 4,24 = ( 5,72. 106 ) / [ ( 106 + 18 x ). 50 ]. 100 Giải ra được x = 10 Vậy công thức tinh thể là Na2CO3. 10H2 O |
0,5 0,5 |
|
|
III |
1 |
– Khí O2 được thu bằng giải pháp rời chỗ của nước. Trên cơ sở đặc thù O2 không phản ứng với nước và O2 ít tan trong nước. PTHH : 2KM nO4 to → K2MNO4 + MnO2 + O2 |
0,5 0,25 |
|
2 |
– Ống 1 không xảy ra phản ứng. Sau phản ứng mCaO = 0,01 x 56 = 0,56 ( g ) – Ống 2 có phản ứng : 4H2 + Fe3O4 to → 3F e + 4H2 O 0,01 0,03 0,04 ( mol ) Sau phản ứng khối lượng chất rắn trong ống 2 là mFe = 0,03 × 56 = 1,68 ( g ) – Ống 3 không sảy ra phản ứng. Khối lượng chất rắn sau : m Al2O3 = 0,02 x 102 = 2,04 ( g ) – Ống 4 có phản ứng : H2 + CuO to → Cu + H2O 0,01 0,01 0,01 ( mol ) Sau phản ứng khối lượng chất rắn trong ống 2 là : mCu = 0,01 × 64 = 0,64 ( g ) – Ống 5 Có phản ứng : H 2O + Na2O → 2N aOH nban đầu 0,05 0,06 ( mol ) np / ư 0,05 0,05 0,1 ( mol ) nsau p / ư 0,01 0,1 ( mol ) Sau phản ứng khối lượng chất rắn trong ống 5 là : mrắn = 0,01 × 62 + 0,1 × 40 = 4,62 ( g ) Hoặc mrắn = 0,05 x 18 + 0,06 x 62 = 4,62 ( g ) |
0,25 0,25 0,25 0,25 0,25 |
Trên đây là trích dẫn một phần nội dung tài liệu Đề thi học sinh giỏi cấp huyện môn Hóa học 8 – Phòng GD và ĐT Kinh Môn. Để xem thêm nhiều tài liệu tìm hiểu thêm hữu dụng khác những em chọn công dụng xem trực tuyến hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính. Ngoài ra những em học sinh hoàn toàn có thể tìm hiểu thêm những tài liệu cùng phân mục :
- Đề thi học sinh giỏi cấp huyện môn Hóa học 8- Phòng GD & ĐT Quan Sơn có đáp án
- Đề thi học sinh giỏi cấp huyện Lịch sử 8- Phòng GD& ĐT Hương Thủy có đáp án
Chúc những em học tốt !
Source: https://evbn.org
Category: Học Sinh















![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


