Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập – Hóa 8 bài 44
Nồng độ mol và nồng độ phần trăm của dung dịch là 2 trong số những công thức quan trọng thường xuyên được vận dụng để giải các bài tập hóa liên quan nồng độ dung dịch ở bậc THCS, THPT.
Bài này chúng ta sẽ củng cố lại khái niệm và công thức về nồng độ phần trăm, nồng độ mol của dung dịch. Làm quen với thao tác pha chế dung dịch và rèn luyện các kỹ năng tính toán.
I. Nồng độ mol, nồng độ phần trăm: Kiến thức cần nhớ
Bạn đang xem: Nồng độ Mol, Nồng độ phần trăm của dung dịch: Bài tập luyện tập – Hóa 8 bài 44
1. Độ tan của một chất trong nước là gì? Những yếu tố nào ảnh hưởng đến độ tan?
a) Độ tan của một chất trong nước (kí hiệu S) là số gam chất đó tan trong 100 gam nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định
* Ví dụ: SNaCl (25oC) = 36g có nghĩa là ở 250C, trong 100 gam nước chỉ có thể hòa tan tối đa là 36 gam NaCl để tạo ra dung dịch NaCl bão hòa
b) Yếu tố ảnh hưởng đến độ tan của một chất trong nước là nhiệt độ (đối với độ tan của chất khí trong nước còn phụ thuộc vào áp suất)
* Ví dụ: SNaCl (100oC) = 39,8g; SO2 (20oC, 1atm) = 0,005g.
2. Nồng độ dung dịch cho biết những gì?
Nồng độ phần trăm và nồng độ mol cho biết điều gì?
a) Nồng độ phần trăm của dung dịch (kí hiệu là C%) cho ta biết số gam chất tan có trong 100 gam dung dịch.
Công thức tính nồng độ phần trăm của dung dịch:
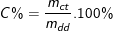
* Ví dụ: Dung dịch đường 20% cho biết trong 100g dung dịch có hòa tan 20 gam đường.
b) Nồng độ mol của dung dịch (kí hiệu là CM) cho ta biết số mol chất tan có trong 1 lít dung dịch.
Công thức tính nồng độ mol của dung dịch là:
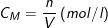
* Ví dụ: Dung dịch H2SO4 0,5M cho biết trong 1 lít dung dịch có hòa tan 0,5 mol H2SO4
3. Cách pha chế dung dịch như thế nào?
Để pha chế dung dịch theo nồng độ cho trước, ta thực hiện hai bước sau:
– Bước 1: Tính các đại lượng cần dùng
– Bước 2: Pha chế dung dịch theo các đại lượng đã xác định
* Ví dụ: Pha chế 200 gam dung dịch NaCl 20%
Bước 1: mNaCl= (200. 20):100= 40 gam
mH2O= mdd – mct = 200- 40 = 160 gam
Bước 2: Cách pha chế
– Cân 40 gam NaCl khan cho vào cốc
– Cân 160 gam H2O (hoặc đong 160 ml nước) cho dần dần vào cốc và khuấy cho đến khi tan hết, ta được 200 gam dung dịch NaCl 20%.
II. Bài tập vận dụng tính nồng độ mol, nồng độ phần trăm của dung dịch
* Bài 1 trang 151 SGK Hóa 8: Các kí hiệu sau cho chúng ta biết những điều gì?
a) SKNO3 =31,6g; SKNO3(100oC) =246g;
SCuSO4 = 20,7g; SCuSO4(100oC) =75,4g.
b) SCO2(20oC,1atm) =1,73g; SCO2(60oC,1atm) = 0,07g
* Lời giải:
Các kí hiệu cho biết:
a)- Độ tan của KNO3 ở 20oC là 31,6g, ở 100oC là 246g.
– Độ tan của CuSO4 ở 20°C là 20,7g, ở 100°C là 75,4g
b) Độ tan của khí CO2 ở 20oC 1atm là 1,73g ở 60oC 1atm là 0,07g.
* Bài 2 trang 151 SGK Hóa 8: Bạn em đã pha loãng axit bằng cách rót từ từ 20g dung dịch H2SO4 50% vào nước và sau đó thu được 50g dung dịch H2SO4.
a) Tính nồng độ phần trăm của dung dịch H2SO4 sau khi pha loãng.
b) Tính nồng độ mol của dung dịch H2SO4 sau khi pha loãng biết rằng dung dịch này có khối lượng riêng là 1,1g/cm3.
* Lời giải:
a) Tính nồng độ phần trăm của dung dịch H2SO4 sau khi pha loãng.
Theo bài ra, và từ công thức tính nồng độ phần trăm, ta có:
![]()
(tức là trong 20g dung dich H2SO4 ban đầu có 10g chất tan H2SO4)
Sau khi pha loãng thì khối lượng dd là 50g (mdd = 50g); Vậy nộng độ phần trăm của H2SO4 sau khi pha loãng là:
![]()
b) Tính nồng độ mol của dung dịch H2SO4 sau khi pha loãng biết rằng dung dịch này có khối lượng riêng là 1,1g/cm3.
– Ta có: 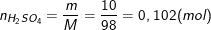
– Lại có: ![]()
Vậy nồng độ mol của dung dịch H2SO4 sau khi pha loãng là:
![]()
* Bài 3 trang 151 SGK Hóa 8: Biết SK2SO4 = 11,1g. Hãy tính nồng độ phần trăm của dung dịch K2SO4 bão hòa ở nhiệt độ này.
* Lời giải:
– Theo bài ra, ta có: mdd (K2SO4) = (100 + 11,1)g = 111,1g
Vậy nồng độ phần răm của dung dịch K2SO4 là:
![]()
* Bài 4 trang 151 SGK Hóa 8: Trong 800ml của một dung dịch có chứa 8g NaOH.
a) Tính nồng độ mol của dung dịch này.
b) Phải thêm bao nhiêu ml nước vào 200ml dung dịch này để được dung dịch NaOH 0,1M?
* Lời giải:
a) Tính nồng độ mol của dung dịch NaOH.
– Theo bài ra, ta có: 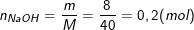
Đổi đơn vị: 800ml = 0,8(lít)
Vậy ta có nồng độ mol của dung dịch NaOH là:
![]()
b) Tính lượng nước cần thêm
– Ta tính số mol NaOH có trong 200ml (=0,2 lít) dung dịch NaOH 0,25M là:
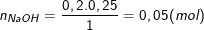
– Vậy thể tích dung dịch sau khi thêm để được dung dịch NaOH 0,1M là:
![]()
Nên thể tích của nước cần dùng để pha loãng 200ml dung dịch NaOH 0,25M để dung dịch NaOH 0,1M là:
VH2O = 500 – 200 = 300ml.
* Bài 5 trang 151 SGK Hóa 8: Hãy trình bày cách pha chế:
400g dung dịch CuSO4 4%.
300ml dung dịch NaCl 3M.
* Lời giải:
Cách pha chế:
– Khối lượng của đồng sunfat là:
![]()
mH2O = mdd = mct = 400 – 16 = 384g.
Cho 16g CuSO4 vào cốc, cho thêm 384 nước vào cốc và khuấy đều cho CuSO4 tan hết, ta được 400g dung dịch CuSO4 4%.
nNaCl trong 300ml (= 0,3 lít) dung dịch:
n = CM.V = 3.0,3 = 0,9 mol, mNaCl = 0,9 .58,5 = 52.65g.
Cho 52,65g NaCl vào cốc thêm nước vừa cho đủ 300ml dung dịch ta được 300ml dung dịch NaCl 3M.
* Bài 6 trang 151 SGK Hóa 8: Hãy trình bày cách pha chế:
a) 150 g dung dịch CuSO4 2% từ dung dịch CuSO4 20%
b) 250 ml dung dịch NaOH 0,5 M từ dung dịch NaOH 2M
* Lời giải:
Cách pha chế:
a) 150 g dung dịch CuSO4 2% từ dung dịch CuSO4 20%
Khối lượng chất tan cần để pha 150 g dung dịch CuSO4 2% là:
![]()
Khối lượng dung dịch CuSO4 20% ban đầu có chứa 3 g CuSO4 là:
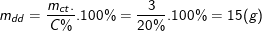
Khối lượng nước cần pha chế là: mnước = 150 – 15 = 135 g.
Pha chế: lấy 15 g dung dịch CuSO4 20% vào cốc thêm 135 g H2O vào và khuấy đều, được 150g dung dịch CuSO4 2%.
b) 250 ml dung dịch NaOH 0,5 M từ dung dịch NaOH 2M
Số mol chất tan trong 250ml (0,25 lít) dung dịch NaOH 0,5M là:
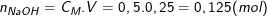
Thể tích dung dịch NaOH 2M có chứa 0,125 mol NaOH là:
![]()
Pha chế: Đong lấy 62,5 ml dung dịch NaOH 2M cho vào cốc chia độ có dung tích 500ml. Thêm từ từ nước cất vào cốc đến vạch 250 ml và khuấy đều ta được 250 ml dung dịch 0,5M.
Hy vọng với nội dung bài tập luyện tập về cách tính Nồng độ Mol, Nồng độ phần trăm của dung dịch, pha chế dung dịch ở trên giúp các em đã nắm vững phần kiến thức này. Mọi thắc mắc và góp ý các em hãy để lại bình luận dưới bài viết để THPT Sóc Trăngghi nhận và hỗ trợ, chúc các em học tốt.
Đăng bởi: THPT Sóc Trăng
Chuyên mục: Giáo Dục
Bản quyền bài viết thuộc trường trung học phổ thông Sóc Trăng. Mọi hành vi sao chép đều là gian lận.
Nguồn chia sẻ: Trường THPT Thành Phố Sóc Trăng (thptsoctrang.edu.vn)














![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


