Những kiến thức cần nhớ về Este chính xác nhất
Những kiến thức cần nhớ về Este chính xác nhất
Este là bài mở đầu cho chương trình Hóa học lớp 12, đồng thời cũng là bài tiếp nối phần hóa học hữu cơ kì 2 lớp 11. Vậy câu hỏi đặt ra ở đây Este là gì? Phản ứng Este hóa, công thức tổng quát của este có khác so với những chất hữu cơ mà bạn đã được học hay không? Ở bài viết này Cunghocvui sẽ trả lời và chỉ ra những điểm giống khác nhau giữa Este và các chất hữu cơ khác, cùng tìm hiểu ngay thôi!
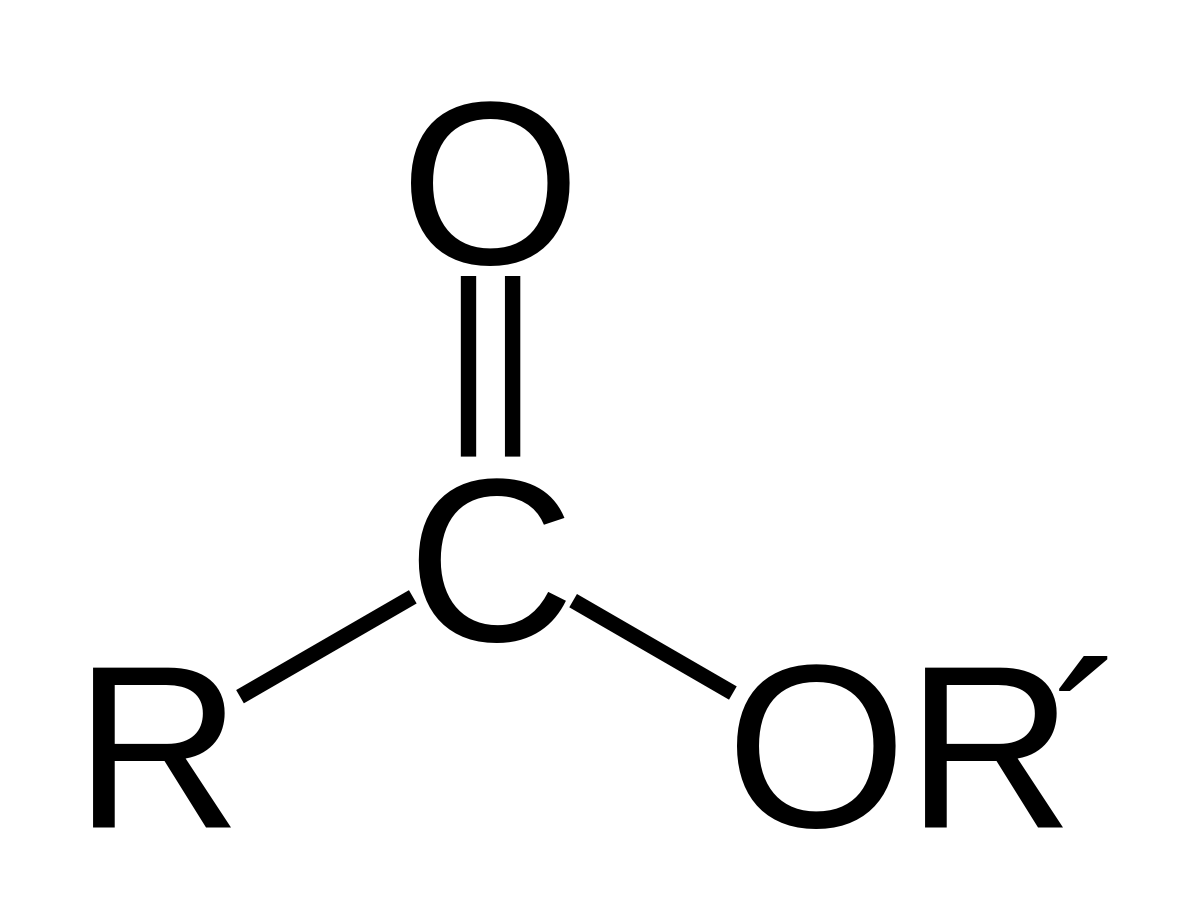
I) Este
1) Este là gì?
Este là sản phẩm được tạo thành sau khi thay nhóm -OH ở cacboxyl của axit cacboxylic bằng nhóm -OR’ của ancol
2) Công thức tổng quát của este
– Este có công thức chung là RCOO-R’
– Riêng với este no ta có công thức: \(C_nH_{2n}O_n (n\geq 2)\)
Lưu ý:
– R là gốc hidrocacbon của axit
– R’ là gốc hidrocacbon của ancol (R’ khác H)
3) Phân loại
Dựa vào các gốc hidroxit và số nhóm cacbonxyl khác nhau mà ta chia ra thành nhiều loại khác nhau như: este no, este không no, este đơn chức hay đa chức,…
4) Đồng phân
– Với Este no ta có thể có những đồng phân mạch hở sau:
+) Axit no, đơn chức
+) Este no, đơn chức
+) Andehit – rượu
+) Xeton – rượu
+) Andehit – ete
+) Xeton – ete
– Các đồng phân este đơn chức gồm có đồng phân mạch cacbon của ancol và đồng phân mạch cacbon của gốc axit tạo thành este.
5) Danh pháp
a) Ancol đơn chức (R’OH)
Tên Este = Tên gốc hidrocacbon R’ + Tên gốc axi
VD: CH3COOC2H5: etyl axetat
b) Ancol đa chức
Tên Este = Tên Ancol + Tên gốc axi
VD: CH2OOC-CH3: etylenglycol điaxetat
Lưu ý: Đổi đuôi “ic” thành “at”
II) Lý thuyết Este
1) Tính chất vật lý
– Trạng thái: chất lỏng. Riêng những este có KLPT rất lớn có thể ở trạng thái như là: mỡ động vật, sáp ong.
– Nhiệt độ sôi: Thấp, dễ bay hơi do không tạo được liên kết giữa các hidro.
– Este có mùi đặc trưng
-
Isoamyl axetat:
\(CH_3COOCH_2(CH_3)_2\)
: mùi chuối
-
Etyl butirat:
\(CH_3CH_2CH_2COOC_4H_9\)
: mùi dứa
-
Geranyl axetat:
\(CH_3COOC_{10}H_{17}\)
: mùi hoa hồng
– Là dung môi tốt để hòa tan các hữu cơ.
2) Tính chất hóa học
a) Este trong phản ứng thủy phân
– Phương trình phản ứng
\(R_y(COO)_{xy}R’_x + _{xy}R \leftrightarrow _yR(COOH)_x + xR'(OH)_y\)
– Điều kiện thực hiện: Môi trường thực hiện phản ứng thủy phân phải là axit loãng và được đun nóng.
– Để tăng hiệu suất phản ứng thủy phân este thì phải dùng dư nước, thêm xúc tác là axit rồi đun nóng
– Trong phản ứng sinh ra acol không bền thì phản ứng thủy phân xảy ra một chiều.
b) Este trong phản ứng thủy phân trong môi trường kiềm
– Phương trình phản ứng
\(R_y(COO)_{xy}R’_x+_{xy}NaOH \rightarrow _yR(COONa)_x + _xR'(OH)_y\)
– Công thức
\(m_{chất rắn sau phản ứng} = m_{muối} + m_{kiềm dư}\)
Số mol este phản ứng: \(n_{este phản ứng}= n_{NaOH phản ứng} = n_{muối} = n_{ancol}\)
Có thể bạn quan tâm: Khái niệm về xà phòng và chất giặt rửa tổng hợp
III) Các dạng bài tập este và cách giải
1) Dạng 1: Bài toán về phản ứng thủy phân este
a) Thủy phân một este đơn chức
– Với môi trường axit
Phản ứng xảy ra thuận nghịch: \(RCOOR’ + HOH \rightarrow RCOOH +R’OH (H^+,t^0)\)
– Với môi trường kiềm (hay còn gọi là phản ứng xà phòng hóa)
Phản ứng một chiều, cần đun nóng: \(R’COOR’ + NaOH \rightarrow RCOOH +R’OH (t^0)\)
Nhận xét:
(1) Nếu \(n_{NaOHphản ứng} = n_{este}\) thì đó là Este đơn chức
(2) Nếu este đơn chức có gốc R’ là \(C_6H_5\) (hoặc vòng benzen) thì \(n_{NaOHphản ứng} = 2n_{este}\), trong sản phẩm có 2 muối (có phenolat)
b) Thủy phân hỗn hợp các este
c) Thủy phân các este đa chức
– \(R(COOR’)_n +nNaOH \rightarrow R(COONa)_n +nR’OH\)với \(n_{ancol}=n.n_{muối}\)
– \((RCOO)_nR’ +nNaOH \rightarrow nRCOONa + R'(OH)_n\)với \(n_{muối}=n.n_{ancol}\)
– \(R(COO)_nR’ + nNaOH \rightarrow R(COONa)_n + R'(OH)_n\)với \(n_{ancol}= n_{muối}\)
2) Dạng 2: Bài toán về phản ứng este hóa
\(RCOOH + R’OH \leftrightharpoons RCOOR’ +H_2O (H_2SO_4, t^0)\)
a) Tìm hằng số cân bằng K
\(K_{cb} = \dfrac{\left | RCOOR’ \right|\left [H_2O \right ]}{\left | RCOOH \right |\left | R’OH \right |}\)
b) Tính hiệu suất phản ứng este hóa
H= (lượng este thu được trên thực tế/lượng este thu được theo lý thuyết).100%
c) Tính lượng este tạo thành hoặc cacbonxylic cần dùng,...
3) Dạng 3: Bài toán về phản ứng đốt cháy este
Đặt công thức có dạng \(C_xH_yO_z(x,z \geq 2, y \leq 2\), y là số chẵn)
Phương trình phản ứng hóa học: \(C_xH_yO_z +(x + \dfrac {y}{4}- \dfrac {z}{2})O_2 \rightarrow xCO_2 + \dfrac{y}{2}H_2O\)
– Đối cháy este thu được \(n_{H_2O} = n_{CO_2}\)thì là este đó no, đơn chức, mạch hở.
– Đốt cháy este thu được \(n_{H_2O} < n_{CO_2}\) thì là este đa chức và axit cacbonxylic đa chức, có 2 liên kết \(\pi \) trở lên.
4) Dạng 4: Bài toán hỗn hợp este và các chất hữu cơ khác
a) 2 muối và 1 ancol thì có khả năng chất hữu cơ đó là: \(RCOOR’ \) và \(R”COOR’\)(\(n_{NaOH} = n_{R’OH}\)) hoặc \(RCOOR’ \) và \(R”COOH\)(\(n_{NaOH}> n_{R’OH}\))
b) 1 muối và 1 ancol thì có khả năng chất hữu cơ đó là: \(RCOOR’ \) và \(ROH\) hoặc \(RCOOR’ \) và \(RCOOH\) hoặc \(RCOOH\) và \(R’OH\)
c) 1 muối và 2 ancol thì có khả năng sau: \(RCOOR’ \) và \(RCOOR’ ‘\) hoặc \(RCOOR’ \) và \(R”OH\)
Lưu ý: Nếu đề chỉ có “chức este” thì không sao, nhưng nếu đề nói “có chức este” thì cần chú ý ngoài chức este trong phân tử có thể có thêm chức axit hoặc ancol
5) Dạng 5: Bài toán xác định các chỉ số của chất béo: chỉ số axit, chỉ số xà phòng hóa, chỉ số ete, chỉ số iot,…
Để làm tốt được dạng bài tập số 5 ta cần phải nắm chắc các khái niệm sau:
– Chỉ số axit là sô mg ROH cần để trung hòa axit béo tự do có trong 1 gam chất béo.
– Chỉ số xà phòng hóa là số mg ROH cần để xà phòng glixerit và trung hòa axit béo tự do có trong 1 gam chất béo.
– Chỉ số este là số mg ROH cần đề xà phòng glixerit của 1 gam chất béo.
– Chỉ số iot là số gam iot có thể cộng vào nối đôi C=C của 100g chất béo.
IV) Bài tập về este
Bài tập 1: Để xà phòng hóa 35 kg triolein cần 4,939kg NaOH thu được 36,207 kg xà phòng. Chỉ số axit của mẫu chất béo trên là
A. 7
B. 8
C. 9
D. 10
Đ/S: A.7
Bài tập 2: Hoàn thành các phản ứng hóa học sau:
a) \(C_3H_4O_2 + NaOH \rightarrow … +…\)
b) \(… + H_2SO_4 (loãng) \rightarrow …+…\)
c) \(…+AgNO_3 + NH_3 + H_2O \rightarrow …+Ag(kt)+NH_4NO_3\)
Xem thêm bài tập este có lời giải>>> Bài tập este
Trên đây là bài viết tổng hợp những kiến thức cần nhớ của Este, hy vọng sau bài viết này việc học Este của bạn sẽ trở nên dễ dàng và thuận lợi hơn. Hãy comment những thắc mắc và lời giải của bạn xuống phía dưới nhé!















![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


