Giải Bài Tập Hóa Học 11 – Bài 4: Sự điện li của nước – pH – Chất chỉ chỉ thị axit-bazơ (Nâng Cao) – Bàn làm việc – Ghế văn phòng – Nội Thất Thành Dương
Mục Lục
Xem toàn bộ tài liệu Lớp 11: tại đây
Giải Bài Tập Hóa Học 11 – Bài 4 : Sự điện li của nước – pH – Chất chỉ thông tư axit-bazơ ( Nâng Cao ) giúp HS giải bài tập, cung ứng cho những em một mạng lưới hệ thống kiến thức và kỹ năng và hình thành thói quen học tập thao tác khoa học, làm nền tảng cho việc tăng trưởng năng lượng nhận thức, năng lượng hành vi :
Bài 1 (trang 20 sgk Hóa 11 nâng cao): Phát biểu các định nghĩa môi trường axit, trung tính và kiềm theo nồng độ H+ và pH.
Lời giải:
– Môi trường axit [ H + ] > 10-7 ⇒ pH < 7
– Môi trường bazơ [ H + ] < 10-7 ⇒ pH > 7
– Môi trường trung tính [ H + ] = 10-7 ⇒ pH = 7
Bài 2 (trang 20 sgk Hóa 11 nâng cao): Một dung dịch có [OH–] = 2,5.10-10M. Môi trường của dung dịch là:
A. Axit
B. Kiềm
C. Trung tính
D. Không xác lập được .
Lời giải:
Chọn A.
Ta có : pOH = – lg [ OH – ] = – lg2, 5.10 – 10 = 9,6
⇒ pH = 14 – 9,6 = 4,4 < 7
⇒ Môi trường của dung dịch là axit .
Bài 3 (trang 20 sgk Hóa 11 nâng cao): Trong dung dịch HNO3 0,010M, tích số ion của nước là :
A. [ H + ] [ OH – ] = 1,0. 10-14
B. [ H + ] [ OH – ] > 1,0. 10-14
C. [ H + ] [ OH – ] < 1,0. 10-14
D. không xác lập được .
Lời giải:
Chọn A. [ H + ] [ OH – ] = 1,0. 10-14
Bài 4 (trang 20 sgk Hóa 11 nâng cao): Một dung dịch có [H+] = 4,2.10-3M, đánh giá nào dưới đây là đúng?
A. pH = 3,00 ;
B. pH = 4,00 ;
C. pH < 3,00 ;
D. pH > 4,00 .
Lời giải:
Chọn C.
Ta có : pH = – lg [ H + ] = – lg4, 2.10 – 3 = 2,3767 < 3
Bài 5 (trang 20 sgk Hóa 11 nâng cao): Một dung dịch có pH = 5,00, đánh giá nào dưới đây là đúng ?
A. [ H + ] = 2,0. 10-5 M ;
B. [ H + ] = 5,0. 10-4 M ;
C. [ H + ] = 1,0. 10-5 M ;
D. [ H + ] = 1,0. 10-4 M ;
Lời giải:
Xem thêm: Tóm tắt diễn biến trận đánh giữa đăm săn và mtao mxây
Chọn C. Ta có pH = – lg [ H + ] = 5 ⇒ [ H + ] = 1,0. 10-5 M ;
Bài 6 (trang 20 sgk Hóa 11 nâng cao): Ka(CH3COOH) = 1,75.10-5 ; Ka(HNO2) = 4,0.10-4. Nếu hai axit có nồng độ mol bằng nhau và ở cùng nhiệt đô, khi quá trình điện li ở trạng thái cân bằng, đánh giá nào dưới đây là đúng ?
A. [ H + ] CH3COOH > [ H + ] HNO2 ;
B. [ H + ] CH3COOH < [ H + ] HNO2 ;
C. pH ( CH3COOH ) < pH ( HNO2 ) ;
D. [ CH3COO – ] > [ NO2 – ] .
Lời giải:
Chọn B.
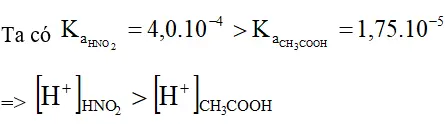
Bài 7 (trang 20 sgk Hóa 11 nâng cao): Hai dung dịch axit đưa ra ở câu 6 có cùng nồng độ mol và ở cùng nhiệt độ, axit nào có độ điện li α lớn hơn?
Lời giải:
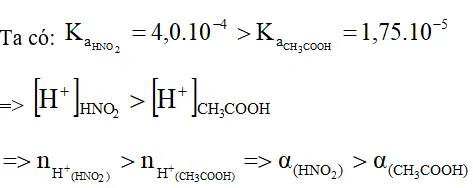
Bài 8 (trang 20 sgk Hóa 11 nâng cao): Chất chỉ thị axit – bazơ là gì? Hãy cho biết màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau.
Lời giải:
Chất thông tư axit – bazơ : Là chất có màu đổi khác phụ thuộc vào vào giá trị pH của dung dịch .
Màu của quỳ và phenolphtanein trong dung dịch ở những khoảng chừng pH khác nhau .
– pH ≤ 6 : Quỳ hóa đỏ, phenolphtanein không màu .
– pH = 7 : Quỳ không đổi màu, phenolphtanein không màu .
– 8 ≤ pH ≤ 8,3 : Quỳ hóa xanh, phenophtanein không màu .
– pH ≥ 8,3 : Quỳ hóa xanh, phenolphtanein hóa hồng .
Bài 9 (trang 20 sgk Hóa 11 nâng cao): Cần bao nhiêu gam NaOH để pha chế 300,0 ml dung dịch có pH = 10,0?
Lời giải:
Ta có : pH = 10 ⇒ pOH = 14 – 10 = 4 ⇒ [ OH – ] = 10-4 M
⇒ nOH – – = [ OH – ]. V = 10-4. 0,3 = 3.10 – 5 mol
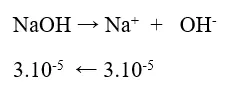
Khối lượng NaOH cần dùng : m = 40.3.10 – 5 = 12.10 – 4 = 0,0012 ( g ) .
Bài 10 (trang 20 sgk Hóa 11 nâng cao):
a ) Tính pH của dung dịch chứa 1,46 g HCl trong 400,0 ml .
b ) Tính pH của dung dịch tạo thành sau khi trộn 100,0 ml dung dịch HCl 1,00 M và 400,0 ml dung dịch NaOH 0,375 M .
Lời giải:
a ) nHCl = 1,46 / 35,5 = 0,04 mol
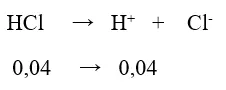
⇒ [ H + ] = 0,04 / 0,4 = 10-1 M ⇒ pH = – lg10-1 = 1
b) nHCl = 0,1 mol; nNaOH = 0,4.0,375 = 0,15 (mol)
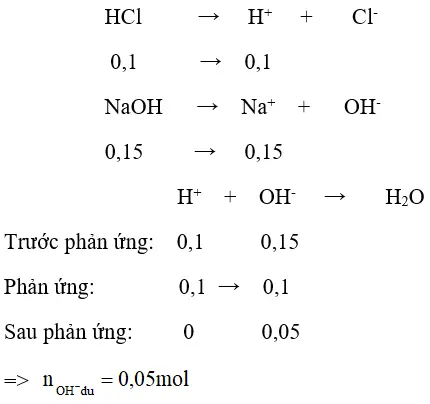
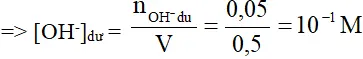
⇒ pOH = – lg [ OH – ] = – lg10-1 = 1 ⇒ pH = 13 .















![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


