GIẢI BÀI TẬP HÓA 11 SÁCH GIÁO KHOA CHƯƠNG I – BÀI 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
Mục Lục
Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
Bài 1 (trang 14 SGK Hóa 11):
Tích số ion của nước là gì và bằng bao nhiêu ở 25oC?
Lời giải:
Tích số ion của nước là tích số của nồng độ H+ và nồng độ OH- ([H+][OH- ] ) trong nước và cả trong các dung dịch loãng của các chất khác nhau. Ở 25oC bằng thực nghiệm, người ta xác định được [H+] = [OH-] = 10-7 (M).
Vậy tích số ion của nước (ở 25oC) là [H+][OH-] = 10-14.
Bài 2 (trang 14 SGK Hóa 11):
Phát biểu định nghĩa môi trường axit, trung tính và kiềm theo nồng độ H+ và pH?
Lời giải:
– Môi trường axit là môi trường trong đó [H+] > [OH-] hay [H+] > 10-7 M hoặc pH < 7.
– Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10-7 M hoặc pH = 7.
– Môi trường kiềm là môi trường trong đó [H+] < [OH-] hay [H+] < 10-7 MM hoặc pH > 7.
Bài 3 (trang 14 SGK Hóa 11):
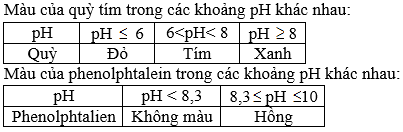
Chất chỉ thị axit – bazơ là gì? Hãy cho biết màu của quỳ tím và phenolphtalein trong các khoảng pH khác nhau?
Lời giải:
Chất chỉ thị axit –bazơ là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Bài 4 (trang 14 SGK Hóa 11):
Một dung dịch có [OH- ]= 1,5.10-5. Môi trường của dung dịch này là:
A. Axit ; C. Kiềm
B. Trung tính ; D. Không xác định được
Lời giải:
– Đáp án C
– Từ [OH-]= 1,5.10-5 (M) suy ra:
Vậy môi trường của dung dịch là kiềm.
Bài 5 (trang 14 SGK Hóa 11):
Tính nồng độ H+, OH- và pH của dung dịch HCl 0,10M và dung dịch NaOH 0,010M?
Lời giải:
Bài 6 (trang 14 SGK Hóa 11):
Dung dịch HCl 0,010M, tích số ion của nước là:
A. [H+][OH- ] > 1,0.10-14 ; B. [H+ ][OH- ] = 1,0.10-14
C. [H+][OH- ] < 1,0.10-14 ; D. Không xác định được
Lời giải:
– Đáp án B.
– Vì tích số ion của nước là hằng số trong nước và cả trong các dung dịch loãng của các chất khác nhau.

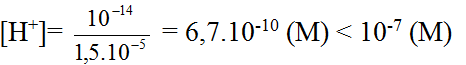















![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


