#1 Công Thức Tính Số Mol. Công Thức Liên Hệ Giữa Nồng độ Mol Và Nồng độ Phần Trăm – Món Miền Trung
Để giải những bài tập hóa học về khối lượng chất, khối lượng dung dịch, thể tích… bạn cần biết được số mol phản ứng của các chất có trong dung dịch Vậy làm thế nào để tính được số mol phản ứng trong bài tập, bởi vì không phải lúc nào đề bài cũng cho trước số mol phản ứng. Câu trả lời có trong nội dung dưới đây. Mời bạn theo dõi.
Số mol là gì?
– Mol là đơn vị trong hóa học, được đo lường theo hệ SI. Một mol có chứa 6,022.1023 số hạt đơn vị phân tử hoặc nguyên tử.
– Số 6,02214129(27)×1023 được gọi là hằng số Avogadro (ký hiệu là NA).
– Số mol là yếu tố quan trọng trong hóa học vì các công thức tính khối lượng, nồng độ, thể tích… đều phải cần có số mol.
Cách tính số mol
Công thức tính số mol nguyên tử
– Như bạn đã biết, một mol có chứa 6,022.1023 số hạt đơn vị nguyên tử và phân tử. Chúng ta có thể dựa vào con số này để tính số mol của chất khi biết được khối lượng nguyên tử hay phân tử của một chất hoặc hợp chất.
– Công thức tính số mol theo hằng số số Avogadro = 6,022.1023 là:
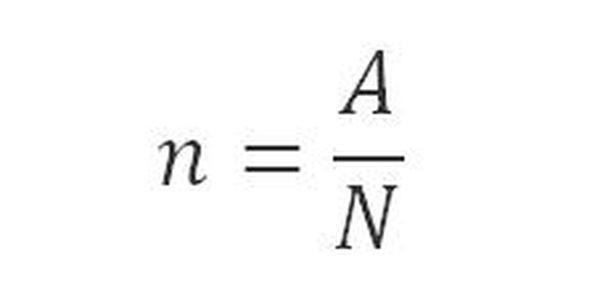
Trong đó:
-
n là số mol chất khí ở điều kiện thường, đơn vị tính là mol
-
A là số nguyên tử hoặc phân tử
-
N là số Avogadro = 6,022.10
23
Công thức tính số mol qua khối lượng
– Khi bài toán cho chúng ta biết khối lượng của chất tham gia phản ứng thì chúng ta dễ dàng tìm được số mol phản ứng của chất hoặc hợp chất đó trong dung dịch. Công thức tính tính số mol theo khối lượng được tính bằng tỉ số giữa khối lượng chất tham gia phản ứng với khối lượng mol của chất đó.
– Công thức tính số mol theo khối lượng là:

Trong đó:
-
n là số mol (mol)
-
m là khối lượng (gam)
-
M là khối lượng mol chất (g/mol)
Công thức số mol ở điều kiện tiêu chuẩn
– Với những chất ở dạng khí, họ thường cho thể tích tham gia phản ứng. Trong hóa học, công thức tính số mol dựa trên thể tích ở điều kiện tiêu chuẩn được xác định bằng công thức sau:

Trong đó:
-
n là số mol chất khí ở điều kiện tiêu chuẩn (mol)
-
V là thể tích khí (lit)
– Lưu ý khi gặp những bài toán cho thể tích thì bạn phải đổi thể tích về đơn vị lít trước khi áp dụng công thức để tính toán.
Công thức tính số mol ở điều kiện thường
– Ở điều kiện bình thường, số mol được tính bằng công thức sau:
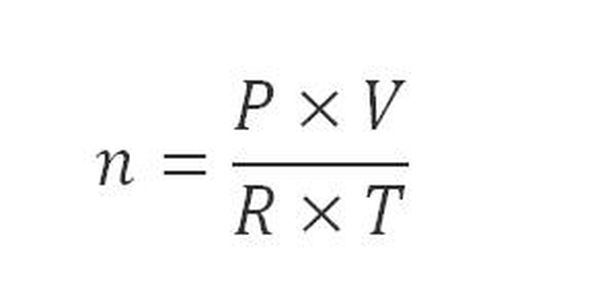
Trong đó:
-
n là số mol chất khí ở điều kiện thường (mol)
-
P là áp suất (atm)
-
V là thể tích khí (lit)
-
R là hằng số = 0.082
-
T là nhiệt độ K, với T = 273 + t (K)
– Tuy nhiên, rất hiếm khi đề bài cho dạng tính số mol ở điều kiện bình thường. Nếu gặp dạng bài này thì bạn nên biết được các giá trị là P (áp suất), hằng số R (0.082) và đổi về nhiệt độ K.
Công thức số mol dư
– Không phải lúc nào các chất đều phản ứng hết với nhau. Khi trong dung dịch, số mol phản ứng được tính theo số mol thấp nhất, chất nào có số mol lớn hơn thì sẽ còn dư.Như vậy số mol dư được tính bằng tổng số mol của chất đó trừ đi số mol đã phản ứng.
– Công thức tính số mol dư là:
Số mol dư = Số mol trong dung dịch – Số mol đã phản ứng
– Ví dụ cụ thể như sau bạn sẽ thấy rõ được cách tính số mol dư như thế nào:
Đốt cháy 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc theo sơ đồ phản ứng sau
P + O2 → P2O5
a) Sau phản ứng chất nào còn dư và nếu dư thì với khối lượng bao nhiêu?
b) Tính khối lượng sản phẩm thu được.
– Giải:
Bước 1. Tính số mol của các chất tham gia phản ứng.
nP = 6,2 : 31 = 0,2 (mol)
nO2 = 6,72 : 22,4 = 0,3 (mol)
Bước 2. Cân bằng phương trình hóa học.
4P + 5O2 → 2P2O5
4 5 2
Bước 3. Dựa vào phương trình phản ứng và tỉ lệ, tìm tỉ lệ số mol và hệ số phản ứng của 2 chất tham gia theo phương trình phản ứng.
nP : 4 = 0,2 : 4 = 0.05
nO2 : 5 = 0,3 : 5 = 0.06
Ta có tỉ lệ phản ứng: nP : 4 < nO2 : 5
=> P phản ứng hết, O2 còn dư.
=> Phương trình tính theo số mol P.
=> nO2 phản ứng = (0.2 x 5) : 4 = 0,25 (mol)
=> Số mol O2 dư = 0,3 – 0,25 = 0,05 (mol)
Cách tính nồng độ mol

Nồng độ mol là gì?
– Nồng độ mol chính là số mol chất tan trong 1 lít dung dịch. Vậy nên khi căn cứ vào nồng độ mol sẽ xác định được mức độ đậm đặc của một dung dịch sau khi xảy ra phản ứng. Và để tính nồng độ mol các bạn cần xác định được số mol chất tan và thể tích của dung dịch.
– Nồng độ mol được kí hiệu là CM, đơn vị là mol/lit.
Nồng độ dung dịch là gì?
– Nồng độ phần trăm dung dịch là lượng chất tan trong 100g dung môi.
– Ví dụ nồng độ dung dịch là 30% thì ta hiểu rằng có 30g chất tan trong 100g dung môi.
Công thức tính nồng độ mol
– Công thức tính nồng độ mol được tính bằng tỉ số giữa số mol và thể tích dung dịch phản ứng.
– Công thức tính độ mol: CM = n/Vdd
Trong đó:
-
C
M
là nồng độ mol
-
n là số mol tham gia phản ứng
-
Vdd là thể tích dung dịch tham giam phản ứng.
– Từ công thức trên chúng ta suy ra
=> Công thức tính số mol chất tan: n = CM x Vdd
=> Công thức tính thể tích dung dịch: Vdd = n/CM
– Ngoài ra còn có cách tính nồng độ Mol dựa trên mối liên hệ giữa nồng độ mol và nồng độ phần trăm. Để tìm hiểu công thức này, bạn hãy theo dõi hết bài viết nhé.
Cách tính nồng độ phần trăm của dung dịch
Nếu đề bài yêu cầu tính nồng độ phần trăm (C%) các chất có trong dung dịch sau phản ứng thì chúng ta cần phải thực hiện các bước sau:
Bước 1. Xác định số chất có trong dung dịch, khối lượng các chất tham gia phản ứng trong dung dịch.
Bước 2. Xác định khối lượng dung dịch sau khi tham gia phản ứng theo công thức:
mdd = khối lượng các chất tan cho vào dung dịch + khối lượng dung môi – khối lượng chất kết tủa – khối lượng chất khí
Bước 3. Tìm khối lượng chất tan cần xác định.
Bước 4. Tính nồng độ phần trăm C% theo công thức tính nồng độ phần trăm ở dưới đây.
Công thức tính nồng độ phần trăm (C%) theo khối lượng
– Nồng độ phần trăm của dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch là bao nhiêu.
– Nồng độ phần trăm được kí hiệu là C%.
– Công thức tính nồng độ phần trăm như sau:

Trong đó:
-
C% là Nồng độ phần trăm
-
mct là khối lượng chất tan
-
mdd là khối lượng chất tan
– Ta có thêm công thức mdd = mct + mdm (mdm là khối lượng của dung môi)
Công thức tính nồng độ phần trăm (C%) theo thể tích
– Khi biết đề không cho khối lượng m mà cho thể tích V và khối lượng riêng D thì ta tính nồng độ phần trăm bằng cách rút ra từ công thức này:

Trong đó
-
n là số mol (mol)
-
C là nồng độ % của dung dịch (%)
-
V là thể tích của dung dịch (ml)
-
D là khối lượng riêng (g/ml)
-
M là khối lượng mol (g/mol)
Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm
– Công thức liên hệ giữa nồng độ mol và nồng độ phần trăm:

Trong đó:
-
C% là Nồng độ phần trăm (%)
-
C
M
là Nồng độ mol/lit (Mol/lit)
-
M Khối lượng mol chất (gam)
-
D Khối lượng riêng của dung dịch (gam/ml)
Xem thêm: Bài giảng công thức tính số Mol cho học sinh mất gốc https://www.youtube.com/watch?v=A67bUEd2ieA
Bài tập tính số mol
Bài tập 1. Cho 3,9 gam Kali vào dung dịch HCl dư. Tính thể tích khí hidro thu được ở điều kiện tiêu chuẩn.
Giải:
Phản ứng xảy ra theo 2 phương trình:
2K + 2HCl → 2KCl + H2 ↑ (1)
2K + 2H2O → 2KOH + H2 ↑ (2)
Số mol Kali: nK = 3,9/39 = 0,1 mol
Theo phương trình phản ứng (1) và (2), nH2 = nK = 0,1 mol
Vậy thể tích khí H2 thu được ở điều kiện tiêu chuẩn là: VH2 = 0,1 x 22,4 = 2,24 lít.
Bài tập 2. Tính nồng độ mol của 5 lít dung dịch có chứa 0,5 mol NaCl.
Giải:
Nồng độ mol sẽ được tính bằng:
CM = 0,5/5 = 0,1M
Bài tập 3. Tính nồng độ mol của dung dịch khi hòa tan 15,8g KMnO4 trong 5 lít nước.
Giải:
Số mol của KMnO4 là: nKMnO4 = 15,8/158 = 0,1 (mol)
Nồng độ mol của dung dịch: CM = 0,1/5 = 0,02M
Bài tập 4. Trong 100ml dung dịch có hòa tan 8 gam NaOH. Tính nồng độ mol của dung dịch.
Giải:
Ta có V = 100ml = 0,1 lít
nNaOH = 8/40 = 0,2 mol
Áp dụng công thức tính CM ta có:
CM = n/V = 0,2/0,1 = 2M
Bài tập 5. Tính khối lượng chất tan có trong 600ml dung dịch CuSO4 có nồng độ mol là 1,5M.
Giải:
Ta có V = 500 ml = 0,5 lít
Áp dụng công thức CM = n/V => nCuSO4 = V x CM = 0,5 x 1,2 = 0,6 (mol)
Khối lượng CuSO4 = nCuSO4 x MCuSO4 = 0,6 x 160 = 96 (g)
Bằng những công thức tính số mol và nồng độ mol trên đây, mong rằng bạn vận dụng tốt vào những bài tập hóa học. Hãy note lại những công thức này nhé, kẻo chừng quên mất công thức đó. Đặc biệt là công thức liên hệ giữa nồng độ mol và nồng độ phần trăm.














![Toni Kroos là ai? [ sự thật về tiểu sử đầy đủ Toni Kroos ]](https://evbn.org/wp-content/uploads/New-Project-6635-1671934592.jpg)


